私たちが知っているように、自然界および人工のすべてのオブジェクトは、何らかの物質でできています。では、次の質問は、これらの物質がどこから来たのかということです。これは何千年もの間問われ続けてきた問いであり、「原子」という概念を持つ科学者によって答えられています。詳細については、csmetrics.org の次の記事を参照してください。
目次
化学における原子研究の歴史

実際、原子の概念は何千年も前に言及されていました。原子の研究の歴史は、18 世紀の古代ギリシャ、19 世紀の原子理論、物理学教授のアンリ ベクレルとマリー キュリーの時代など、いくつかの時期に分けられます。
原子論は、古代ギリシャ語の Atomos (不可分) に由来します。したがって、物質は離散粒子で構成されています。原子論は、実験データに基づく物質と空間の多くの説明の 1 つです。
原子の科学理論のいくつかの注目すべきマイルストーン:
- 1805:ジョン・ダルトンは、有名な英国の化学者、物理学者、気象学者でした。彼はまた、原子の概念を使用して、元素が常に小さな自然数に従って反応する理由と、他の気体よりも水に溶けやすい気体があることを説明する現代の原子理論の先駆者の 1 人でもありました。
「各化学元素には、同じ固有のタイプの原子が含まれており、これらの原子が結合して化合物を形成します。 」(Wikipedia.org)
この原子論では、原子の具体的な大きさについての情報はなく、「非常に小さい」という感覚を通してのみ確認されます。
- 1827年:ロバート・ブラウン – 有名なスコットランドの植物学者は、顕微鏡を使って水に浮かぶ塵の粒子を観察しました。この時点で、彼はそれらがジグザグに移動していることに気付きました。
- 1865年:ヨハン・ヨーゼフ・ロシュミット – オーストリアの科学者が原子の研究で画期的な発見をしました。具体的には、彼は空気中の分子のサイズを計算しました。
- 1905:アルバート アインシュタイン – 偉大なドイツの物理学者は、原子の質量とサイズの分析に成功し、化学者で物理学者のジョン ダルトンの原子理論を確認しました。
アトミックコンセプトとは?
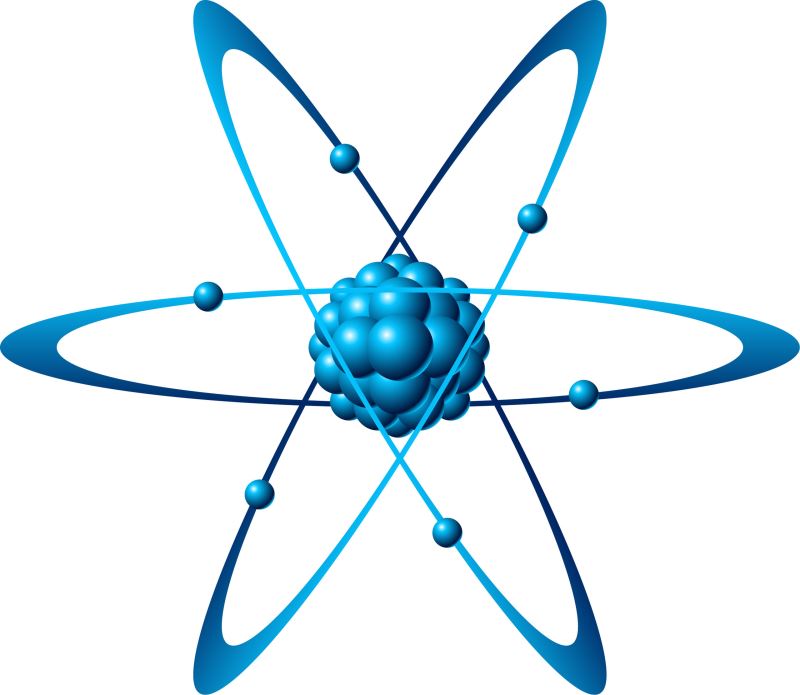
実は、物質は何千万種類もあるのに、原子の種類は約100種類しかありません。原子は、直径わずか約 0.00000001 cm の非常に小さな球体として視覚化されます。
「原子は非常に小さく、電気的に中性の粒子です。原子は、正に帯電した原子核と、1 つまたは複数の負に帯電した電子で構成されるシェルで構成されます。
e で表される電子は最小の負の電荷を持ち、慣習的に負の記号 (-) でマークされます。
原子はどのような粒子からできていますか?
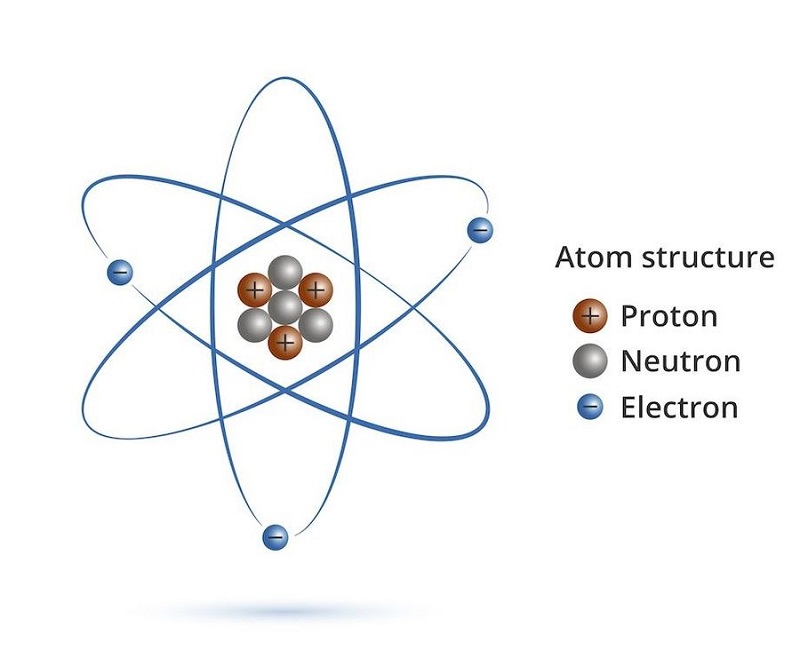
原子が何であるかに関する上記の定義に基づいて、原子は、正に帯電した原子核と、1 つまたは複数の負に帯電した電子で構成されるシェルを含む 2 つのタイプで構成されていることが明確にわかります。
原子に関連するその他の概念
原子の性質を理解するには、原子核、原子内の電子殻、原子質量の定義など、原子に関連するいくつかの概念も学ぶ必要があります。
原子力
原子核は陽子と中性子でできており、原子の中心にあります。陽子は p で表され、電子と同じ電荷を持ちますが、符号が異なります (正の + 符号で示されます)。中性子は電荷を持たず、記号 n です。同じ種類の原子は、核内に同じ数の陽子を持っています。
原子には、電子と同じ数の陽子があります。結論番号 p = 番号 e . 実際、陽子と中性子は同じ質量を持ち、電子は非常に小さく、陽子の約 0.0005 倍しかありません。したがって、科学者は原子核の質量が原子の質量であると考えています。
原子の電子層
原子内では、電子は常に原子核の周りを非常に高速で移動しており、特定の数の電子を含む層に配置されています。そして、電子のおかげで、原子は互いに結合することができます。
原子番号
周期表では、各分子には独自の原子番号があります。原子番号に基づいて、ある元素を別の元素と区別することができます。
原子番号とは?原子番号は、その化学元素の原子核にある陽子の数です。原子が電荷を持たない場合、原子の数は電子の数に等しくなります。
アトミックブロック
「原子質量は、炭素単位で表した原子の質量です。各元素には、独自の原子質量があります」
原子の質量は非常に小さいため、使いにくいため、科学者は従来、炭素原子の質量の 1/12 を原子の質量単位 (略して dc) として使用していました。
原子と分子を区別する
原子について学ぶ過程で、多くの人が原子と分子を混同します。では、これら 2 つの概念をどのように区別するのでしょうか。
|
比較特性 |
原子 |
分子 |
|
概念 |
原子は非常に小さく、電気的に中性の粒子です。原子は、正に帯電した原子核と、1 つまたは複数の負に帯電した電子で構成されるシェルで構成されます。 |
分子は物質の代表であり、多数の原子が結合して構成され、物質の化学的性質を完全に表現しています。 |
|
例えば |
酸素原子、炭素原子 |
酸素 (O2)、水 (H2O) |
|
形 |
球状 |
多くの形 |
|
自然 |
原子を分割できない |
分子内の要素は、互いに分離および結合できます。 |
|
サバイバル |
自由な状態で存在する場合と存在しない場合があります |
自由な状態で存在する |
|
ヴィジョン |
肉眼では見えない |
肉眼では見えませんが、顕微鏡で見ることができます |
|
反応能力 |
高応答、一部例外あり |
反応が少ない |
|
リンク |
核リンク |
共有結合またはイオンプラス結合 |
原子についてのレッスンの知識を統合する演習
レッスン 1: 原子の概念を確認する
「(1) は非常に小さい、電気的に中性の粒子です。(2) 磁気はすべての物質を作成します。原子はプラスに帯電した(3)で構成され、殻は(4)でできています。」
推奨される答え:
(1): 原子
(2): アトム
(3)核
(4) 1 つまたは複数の負に帯電した電子
レッスン 2: 化学の教科書の復習演習 8 ページ 25
銅と鉄はどの元素からできていますか? 金属元素の原子の配置を述べなさい.
推奨される答え:
銅金属はCu元素で構成されています。鉄金属は元素Feで構成されています。
金属元素の原子の配置: それらは密接に、明確な順序で配置されています。
原子は、中学校の化学カリキュラムの中心的な授業です。そのため、このレッスンでは知識を徹底的に復習し、知識をしっかりと把握するために十分な演習を行うことを忘れないでください。研究頑張ってください!
