この記事では、パーセンタイルとパーセンタイル測定に関する最も詳細な一般情報と、ル サトリエールの原理を適用して平衡シフトを決定する方法を読者に提供します。私たちと一緒に今すぐ見つけてください!
目次
化学平衡とは何ですか?一方向反応と可逆反応
化学量論とは何かを理解するために、一方向および可逆反応について学びます。
一方通行の反応とは何ですか?
一方向反応の概念を明確にするために、次の反応を考えます。
2KClO3 -> 2KCl + 3O2 (条件: MnO2、温度)
塩素酸カリウム (KClO3) の結晶を二酸化マンガン (MnO2) 触媒の存在下で加熱すると、KClO3 は塩化カリウム (KCl) と酸素 (O2) に分解します。また、同じ条件下では、塩化カリウム (KCl) と酸素 (O2) が反応して KClO3 を形成することはできません。このように反応は左から右へ一方向にしか起こらず、このような反応を一方向反応と呼びます。
一方向反応の化学式では、矢印は反応の方向を示すために使用されます。
可逆反応
.png)
可逆反応の概念を明確にするためには? 次の反応を考えます。
Cl2 + H2O HCl + HClO
通常の条件下では、Cl2 は水 (H2O) と反応して HCl と HClO を形成し、生成された HCl と HClO も反応して Cl2 と H2O を形成します。したがって、同じ条件下では、反応は反対方向に起こります。このような反応を可逆反応と呼びます。
可逆反応の化学式では、一方通行の反応の矢印ではなく、反対方向の矢印が使用されます。
化学平衡とは何ですか?
では、化学平衡が次のように詳細に定義されています。
この概念をよりよく理解するために、次の可逆反応を検討します。
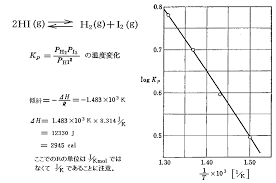
H2(k) + I2(k) 2HI(k)
H2 と I2 を一定の高温の密閉容器に入れます。最初は、H2 と I2 の濃度が大きいため正反応速度 (Vt) は大きく、HI の濃度がゼロであるため逆反応速度 (Vn) はゼロです。反応中、H2 と I2 の濃度は徐々に減少するため、Vt は徐々に減少し、Vn は HI の濃度の増加により徐々に増加します。ある時点で Vt が Vn に等しくなり、温度が変化しなければ、上記の可逆反応における物質の濃度は同じままです。可逆反応のこの状態は化学量論と呼ばれます。
平衡状態では、反応は停止しませんが、正反応と逆反応は依然として発生しますが、速度は同じです (Vt = Vn)。これは、一度に、正反応によって減少したのと同じ量の反応物質の濃度が逆反応によって生成されることを意味します。したがって、化学量論は動的平衡です。
可逆反応の特徴は、反応物が完全に生成物に変換されないため、平衡系では常に反応物と生成物が存在することです。
例えば、0.5 mol/l H2 と 0.5 mol/l I2 を 430 ℃ の密閉容器に入れると、反応が一方向であれば、H2 と I2 がすべて反応して 1 mol/l HI が生成されます。ただし、これは可逆反応であるため、HI は 0.786 mol/l、H2 は 0.107 mol/l、I2 は 0.107 mol/l しか得られません。
化学平衡シフト
オープンKロック付きの柔軟なプラスチックチューブで接続された、分岐(a)と(b)を備えた2つの試験管からなるキットのフィッティングテストを実行します。両方のチューブ (a) と (b) を室温で NO2 ガスで満たし続けます。次のバランスを持つ両方のパイプをシールします。
2NO2 (k – 赤褐色) ⇌ N2O4 (ガス – 無色)
両方のチューブ (a) と (b) で平衡状態にあるガス混合物の色は同じです。K ロックを閉じて、2 つのチューブ内のガスが互いに拡散するのを防ぎます。チューブ (a) を氷にしばらく浸してから取り出し、チューブ (a) とチューブ (b) の色を比較すると、チューブ (a) の方が色が薄いことがわかります。
チューブ (a) を冷却すると、チューブ内の NO2 分子がさらに反応して N2O4 が生成され、NO2 濃度が減少し、N2O4 濃度がさらに増加しました。その現象はストイキオメトリーと呼ばれます。
結論:化学平衡シフトは、平衡に対する外的要因の影響による、ある平衡状態から別の平衡状態への移動です
化学バランスに影響を与える要因
平衡をシフトする要因は、濃度、圧力、および温度です。これらは化学量論的要因と呼ばれます。次のように:
集中力の効果
一定の高温の密閉容器内の次の平衡システムを考えてみましょう。
C(r) + CO2(k) 2CO(k)
反応系が平衡状態にあるとき、つまり Vt = Vn のとき、反応中の物質の濃度はそれ以上変化しません。ある量の CO2 をシステムに追加すると、システム内の CO2 濃度が増加し、Vt が Vn に等しくなり、平衡が確立されます。新しい平衡では、物質の濃度は古い平衡とは異なります。
そのため、CO2 を平衡系に追加すると、平衡は左から右 (前方向) にシフトし、追加された CO2 の濃度が減少します。平衡をシフトするプロセスは、Vn < Vt であるため、平衡から CO を除去するときにも同様に発生します。逆に、平衡系から CO ガスを追加したり、CO2 を除去したりすると、Vt < Vn となり、平衡は右から左へ (反対方向へ)、つまり CO 濃度が減少する方向またはその方向へシフトします。 CO2 濃度の上昇。
結論:平衡状態にある物質の濃度を増減すると、平衡は常に、その物質の濃度を増減する効果を減少させる方向にシフトします。純粋な形の固体を含む平衡系の場合、固体の追加または除去は平衡に影響しません。つまり、平衡はシフトしません。
上記は、理論の詳細な要約と、化学平衡に関するいくつかの演習です。効率的な学習と高い成果をお祈りします。
